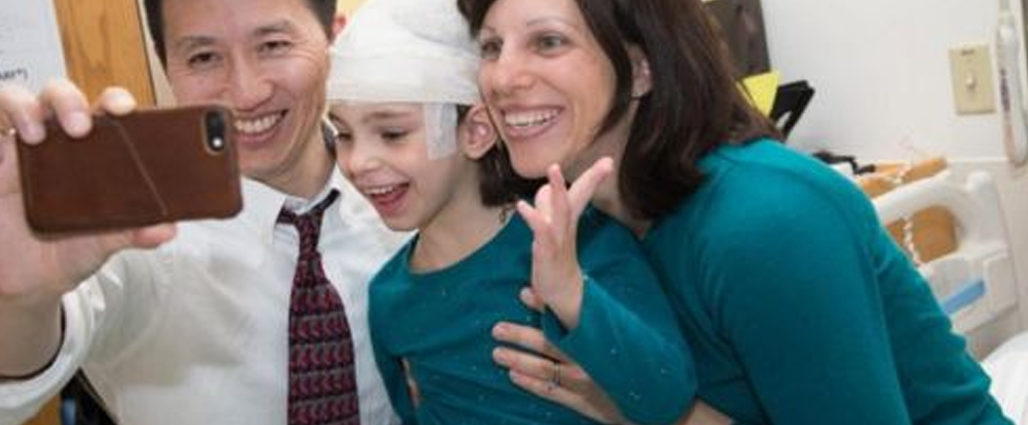
Mila Makovec tiene 8 años y una enfermedad cerebral letal. Es posible que no viva muchos más, pero ya ha hecho historia.
Es la primera paciente del mundo a la que se administra un fármaco hecho específicamente para ella que, además, se ha diseñado en tiempo récord.
La niña fue diagnosticada con una condición mortal y hereditaria: la enfermedad de Batten, un trastorno del sistema nervioso que comienza en la niñez.
En menos de un año los médicos del Hospital Infantil de Boston, EE.UU., crearon un fármaco hecho a medida que corrige los errores de su ADN.
Aunque no está curada del todo, ahora tiene muchas menos convulsiones.
La enfermedad de Batten
Es un trastorno extremadamente raro, que progresivamente va a peor y siempre tiene un final fatal.
Mila tenía 3 años cuando su pie derecho comenzó a torcerse hacia dentro. Un año más tarde, necesitaba colocar los libros más cerca de su cara para poder verlos bien y a los 5 años, a veces se caía y su forma de caminar se volvió extraña.
A los 6, Mila estaba ciega, apenas podía hablar y sufría convulsiones.
La enfermedad puede ser causada por una variedad de mutaciones genéticas que impiden que las células puedan descomponer y reciclar los desechos.
En lugar de eso, éstos se acumulan, lo cual puede provocar la muerte de las células cerebrales.
De camino a la terapia
La familia de Mila recibió el diagnóstico de la enfermedad de Batten que sufría la niña y supieron que era genética.
Lanzaron una campaña –Mila’s Micacle Foundation (la fundación del milagro de Mila)- con la esperanza de curar lo incurable.

«Estábamos sentados a la mesa una noche para cenar cuando mi esposa me contó que una amiga había compartido una publicación de Facebook de una familia en Colorado (EE.UU.) que pedía ayuda», le contó el doctor Timothy Yu a la BBC.
Yu conoció a Mila por primera vez en enero de 2017 y lo que siguió fue un proceso increíblemente rápido y sin precedentes.
El equipo en Boston realizó una secuenciación del genoma completo -un análisis detallado- sobre el ADN de Mila, su código genético, y descubrió una mutación única que estaba causando su enfermedad.
Tras identificar el fallo, los investigadores pensaron que sería posible tratarlo.
Diseñaron un fármaco, lo probaron en las células de Mila y en animales en el laboratorio y obtuvieron la aprobación para usarlo por parte de la Administración de Alimentos y Medicamentos de Estados Unidos.
Mila comenzó el tratamiento con el fármaco -al que llamaron Milasen– el 31 de agosto de 2018.
En tiempo récord
Los medicamentos normales tardan alrededor de una década y media en llegar del laboratorio, pasar por ensayos clínicos y llegar a manos de los pacientes.
El equipo estadounidense lo hizo en un año.
«Cuando nos detuvimos y miramos atrás, nos sentimos muy orgullosos y sorprendidos. A veces es útil ser idealista, y saber que teníamos una niña que estaba empeorando mientras hacíamos el trabajo nos motivó a todos a actuar increíblemente rápido», dijo Yu.
«No tenemos conocimiento de otro caso en el que una droga se haya diseñado de esta manera», añadió el doctor.
¿Qué significa para Mila?
El fármaco no puede deshacer todo el daño que ya tiene.
«Yo diría que durante el primer año estuvimos maravillados. Parecía que había muy poca progresión de la enfermedad«, le dijo Yu a la BBC.
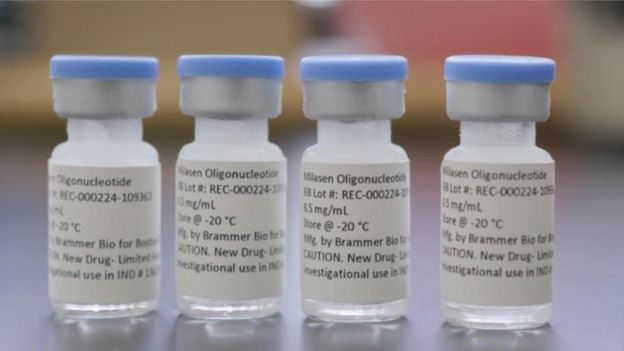
Pero en esta enfermedad, el declive suele ser inevitable.
La frecuencia de las convulsiones de Mila cayó de 15 a 30 por día, con una duración de alrededor de dos minutos, a entre 0 y 20 por día, en su mayoría de unos pocos segundos.
La familia anunció que estaba más erguida y que tragaba mejor.
Sin embargo, hay señales en su segundo año de tratamiento de que la enfermedad está avanzando nuevamente, y Mila continúa siendo monitoreada de cerca.
«Creemos que (la enfermedad) está progresando más lentamente de lo que lo haría de otro modo, y tenemos la esperanza de que pueda estabilizarse todavía más», explicó Yu.
El médico cree que si en casos futuros es posible intervenir incluso antes, cuando un niño tiene 3 ó 4 años, «realmente podría marcar una enorme diferencia».
¿Cómo funciona el medicamento?
El enfoque que se usó es muy inteligente y requería una comprensión precisa de lo que estaba pasando exactamente.
Una instrucción genética le hacía Mila construir una proteína defectuosa en su ADN. La proteína ineficaz resultante estaba causándole la enfermedad de Batten.
Para ello se crea el ARN mensajero, que lleva las instrucciones del núcleo de la célula del ADN al sitio donde se fabrican las proteínas.
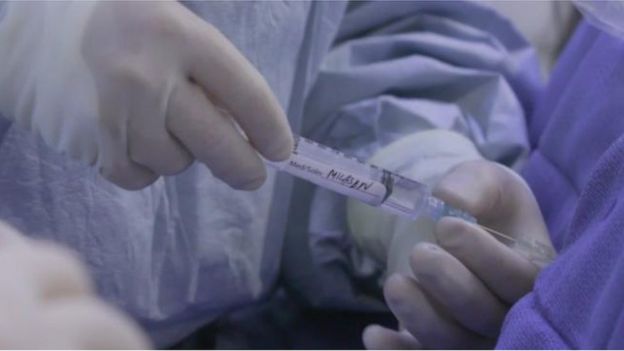
Pero hubo un problema con la construcción del mensajero en el caso de Mila que generó el mensajero equivocado. El resultado fue la proteína defectuosa.
El fármaco que desarrollaron los médicos se adhiere al ARN en formación y evita que se corte en el lugar equivocado.
Esa misma tecnología, la terapia de oligonucleótidos antisentido (ASO), ofrece la primera esperanza de tratar la devastadora enfermedad de Hungtinton.
Los detalles fueron publicados en la revista médica The New England Journal of Medicine.
¿Cuánto cuesta todo esto?
Una de las mayores barreras para que la gente pueda beneficiarse de esta medicina es su alto costo.
El equipo de investigación no dijo mucho sobre cuánto gastaron en el desarrollo del fármaco.
Pero el doctor Yu le contó a la BBC lo siguiente: «No habríamos avanzado si no hubiéramos visto un camino para hacerlo accesible«.
«La idea de (gastar) millones de dólares en medicamentos para millonarios no encaja bien con lo que estamos haciendo».
¿Un nuevo enfoque para la medicina?
Sí.
Hay más de 7.000 enfermedades raras causadas por anormalidades genéticas que a menudo carecen de cualquier forma de tratamiento.
No todas las enfermedades raras, o incluso todos los pacientes con enfermedad de Batten, podrían tratarse de la misma manera que Mila.
Pero la esperanza es que la medicina verdaderamente personalizada, basada en una comprensión genética detallada de lo que causa una enfermedad, pueda conducir a este tipo de tratamientos de precisión.
La doctora Janet Woodcock, del organismo regulador de medicamentos de la Administración de Drogas y Alimentos de Estados Unidos, dijo que los fármacos individualizados, conocidos como N-of-one porque son utilizados por una sola persona, producen nuevos problemas.
«En estas situaciones, ¿qué tipo de evidencia se necesita antes de exponer a un humano a un nuevo medicamento?»
«Incluso en enfermedades mortales que progresan rápidamente, precipitar complicaciones graves o la muerte no es aceptable; ¿cuál es la garantía mínima de seguridad necesaria?»
BBC